1、醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)化現(xiàn)狀
1.1 國外醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)化現(xiàn)狀

1.1.1 ISO 標(biāo)準(zhǔn)
國際標(biāo)準(zhǔn)化組織外科植入物技術(shù)委員會 (ISO/TC 150) 負(fù)責(zé)制定永久或暫時(shí)性植入人體的醫(yī)療產(chǎn)品標(biāo)準(zhǔn)?ISO 外科植入物用材料標(biāo)準(zhǔn)為 ISO 5832 系列標(biāo)準(zhǔn)�����,現(xiàn)行有效的共計(jì) 4 項(xiàng)����,見表 1?該系列標(biāo)準(zhǔn)規(guī)定了材料的基礎(chǔ)特性���,涵蓋組織成分?機(jī)械性能和顯微結(jié)構(gòu)等內(nèi)容?
表 1 ISO 醫(yī)用植入物鈦材標(biāo)準(zhǔn)
| 序號 | 標(biāo)準(zhǔn)編號 | 標(biāo)準(zhǔn)名稱 |
| 1 | ISO 5832-2/1999 | 外科植入物金屬材料第 2 部分:純鈦加工材 |
| 2 | ISO 5832-3/1996 | 外科植入物金屬材料第 3 部分:Ti-6Al-4V 合金加工材 |
| 3 | ISO 5832-11/2014 | 外科植入物金屬材料第 11 部分:Ti-6Al-7Nb 合金加工材 |
| 4 | ISO 5832-14/2007 | 外科植入物金屬材料第 14 部分:Ti-15Mo-5Zr-3Al 合金加工材 |
1.1.2 美國 ASTM 標(biāo)準(zhǔn)
美國材料與試驗(yàn)協(xié)會制定的外科植入物用鈦標(biāo)準(zhǔn)共計(jì) 10 項(xiàng),見表 2?在 ASTM 標(biāo)準(zhǔn)中��,增加了第三代外科植入物用 Ti-13Nb-13Zr 等鈦合金標(biāo)準(zhǔn)����,并針對鈦金屬鍛件?無縫管和粉末設(shè)立了專項(xiàng)標(biāo)準(zhǔn),內(nèi)容上增加了尺寸公差?表面污染層控制?無損檢測等關(guān)鍵要求?
表 2 美國 ASTM 醫(yī)用植入物鈦材標(biāo)準(zhǔn)
| 序號 | 標(biāo)準(zhǔn)編號 | 標(biāo)準(zhǔn)名稱 |
| 1 | ASTM F67-13 | 外科植入物用純鈦加工材 |
| 2 | ASTM F136-13 | 外科植入物用 Ti-6Al-4V ELI 合金加工材 |
| 3 | ASTM F620-15 | 外科植入物用 α+β 鈦合金鍛件 |
| 4 | ASTM F1295-11 | 外科植入物用 Ti-6Al-7Nb 合金加工材 |
| 5 | ASTM F1472-14 | 外科植入物用 Ti-6Al-4V 合金加工材 |
| 6 | ASTM F1580-12 | 外科植入物覆層用純鈦?Ti-6Al-4V 合金粉末 |
| 7 | ASTM F1713-08 | 外科植入物用 Ti-13Nb-13Zr 合金加工材 |
| 8 | ASTM F1813-13 | 外科植入物用 Ti-12Mo-6Zr-2Fe 合金加工材 |
| 9 | ASTM F2066-13 | 外科植入物用 Ti-15Mo 合金加工材 |
| 10 | ASTM F2146-13 | 外科植入物用 Ti-3Al-2.5V 無縫管 |
1.2 國內(nèi)醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)化現(xiàn)狀
目前�����,我國醫(yī)用植入物用金屬材料相關(guān)國家標(biāo)準(zhǔn)共計(jì) 9 項(xiàng)���,其中包含植入鈦材標(biāo)準(zhǔn) 3 項(xiàng)��,規(guī)定了材料化學(xué)成分?機(jī)械性能?物理性能?性能測試方法等基礎(chǔ)要求?中國醫(yī)療器械行業(yè)標(biāo)準(zhǔn)化工作也在不斷完善�����,相繼制定了醫(yī)用植入物用金屬材料行業(yè)標(biāo)準(zhǔn) 43 項(xiàng),其中包含植入鈦材標(biāo)準(zhǔn) 9 項(xiàng)����,涉及牙科?骨科植入等方面材料和產(chǎn)品的標(biāo)準(zhǔn)要求����,部分相關(guān)標(biāo)準(zhǔn)見表 3?
表 3 我國醫(yī)用植入物鈦材標(biāo)準(zhǔn) (部分)
| 標(biāo)準(zhǔn)編號 | 標(biāo)準(zhǔn)名稱 | 標(biāo)準(zhǔn)類別 |
| GB/T 13810 - 2017 | 外科植入物用鈦及鈦合金加工材 | 國家標(biāo)準(zhǔn) |
| GB/T 24627 - 2009 | 外科植入物用鎳 - 鈦形狀記憶合金加工材 | 國家標(biāo)準(zhǔn) |
| GB 23102 - 2008 | 外科植入物金屬材料 Ti-6Al-7Nb 合金加工材 | 國家標(biāo)準(zhǔn) |
| YY/T 1615 - 2018 | 外科植入物鈦及鈦合金陽極氧化膜通用要求 | 行業(yè)標(biāo)準(zhǔn) |
| YY/T 1823 - 2022 | 心血管植入物鎳鈦合金鎳離子釋放試驗(yàn)方法 | 行業(yè)標(biāo)準(zhǔn) |
| YY 0315 - 2023 | 鈦及鈦合金牙種植體 | 行業(yè)標(biāo)準(zhǔn) |
| YY/T 0512 - 2009 | 外科植入物金屬材料 α+β 鈦合金棒材顯微組織的分類 | 行業(yè)標(biāo)準(zhǔn) |
| YY/T 1802 - 2021 | 增材制造醫(yī)療產(chǎn)品 3D 打印鈦合金植入物金屬離子析出評價(jià)方法 | 行業(yè)標(biāo)準(zhǔn) |
1.3 國內(nèi)外醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)化現(xiàn)狀對比總結(jié)
1.3.1 標(biāo)準(zhǔn)滯后于產(chǎn)品發(fā)展
GB/T 13810 系列標(biāo)準(zhǔn)僅包含了第一代和第二代外科植入物用鈦加工材?對于我國生產(chǎn)的第三代外科植入物用鈦合金 TC26 和 TB11, 以及新研發(fā)的介入器械?植入產(chǎn)品�����,目前還未納入國家標(biāo)準(zhǔn) [1], 且相關(guān)標(biāo)準(zhǔn)更新較慢?
1.3.2 標(biāo)準(zhǔn)內(nèi)容不全面
目前��,國內(nèi)標(biāo)準(zhǔn)中的相關(guān)性能指標(biāo)和技術(shù)要求與國外先進(jìn)標(biāo)準(zhǔn)無明顯差異,但對于測試方法?加工工藝等技術(shù)標(biāo)準(zhǔn)仍需要進(jìn)一步補(bǔ)充細(xì)化?另外�����,由于缺少完善的質(zhì)量保證體系及產(chǎn)品配套工藝 [2], 生產(chǎn)過程中監(jiān)督管理不到位的現(xiàn)象普遍存在?同時(shí)�,現(xiàn)行標(biāo)準(zhǔn)在產(chǎn)品生物安全性評估方面不夠完善�,可能存在安全隱患?
1.3.3 標(biāo)準(zhǔn)實(shí)施推廣力度較弱
目前,部分實(shí)施人員的技術(shù)能力尚未跟上行業(yè)技術(shù)的快速發(fā)展�,標(biāo)準(zhǔn)化意識普遍不強(qiáng)?一些生產(chǎn)廠家對鈦合金材料標(biāo)準(zhǔn)和性能認(rèn)識不足����,導(dǎo)致植入物因材料原因發(fā)生斷裂失效���,進(jìn)而引起醫(yī)療糾紛?
2����、醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系構(gòu)建
2.1 醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系構(gòu)建原則
根據(jù) GB/T 13016-2018《標(biāo)準(zhǔn)體系構(gòu)建原則和要求》, 醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系的構(gòu)建應(yīng)遵循目標(biāo)明確?全面成套?層次適當(dāng)?劃分清楚的原則?
2.2 醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系基本框架
基于標(biāo)準(zhǔn)體系構(gòu)建原則和要求,結(jié)合我國現(xiàn)行醫(yī)用植入物鈦及鈦合金相關(guān)標(biāo)準(zhǔn),搭建出我國醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系基本框架�����,如圖 1 所示?
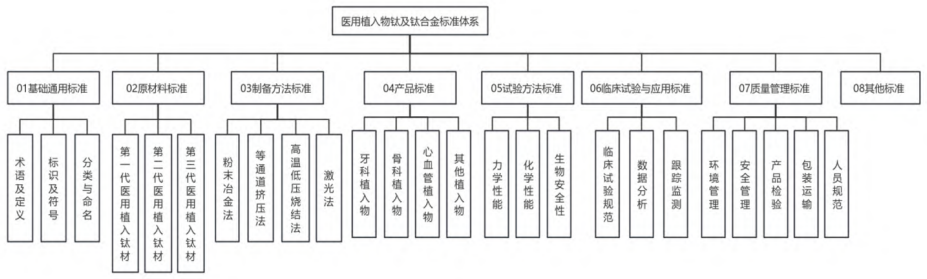
2.3 醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系構(gòu)成要素
2.3.1 基礎(chǔ)通用標(biāo)準(zhǔn)體系
基礎(chǔ)通用標(biāo)準(zhǔn)為其他子系統(tǒng)提供基礎(chǔ)支撐�,是醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系中重要的基礎(chǔ)共性規(guī)范,涵蓋的內(nèi)容包括鈦及鈦合金?脊柱植入物?心血管和牙體植入物的術(shù)語定義?手術(shù)植入物的標(biāo)識要求,以及外科植入物的分類與命名要求?
2.3.2 原材料標(biāo)準(zhǔn)體系
原材料標(biāo)準(zhǔn)細(xì)分為三代醫(yī)用植入鈦材,涵蓋了醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系中的原材料標(biāo)準(zhǔn)及其要求?第一代醫(yī)用植入鈦材是以 GB/T 13810-2017 為代表的外科植入物用鈦及鈦合金加工材標(biāo)準(zhǔn)?第二代醫(yī)用植入鈦材標(biāo)準(zhǔn)主要對材料的化學(xué)成分?機(jī)械性能?抗腐蝕性?生物相容性等方面提出了要求?這些標(biāo)準(zhǔn)幫助醫(yī)療器械制造商和使用者選擇合適的材料進(jìn)行植入手術(shù),同時(shí)確保病人長期健康?第三代醫(yī)用植入鈦材標(biāo)準(zhǔn)依據(jù) ISO 5832 系列標(biāo)準(zhǔn)進(jìn)行了進(jìn)一步修訂,對表面處理和長期生物相容性的要求更加嚴(yán)格,使其能夠適應(yīng)更復(fù)雜的植入需求���,同時(shí)還加入了對新技術(shù) (如表面改性?涂層處理等) 的規(guī)范,以確保植入物的長期使用效果和安全性?
2.3.3 制備方法標(biāo)準(zhǔn)體系
制備方法標(biāo)準(zhǔn)體系細(xì)分為粉末冶金法?等通道擠壓法?高溫低壓燒結(jié)法?激光法�,主要包括醫(yī)用植入鈦材料生產(chǎn)加工過程中常用的幾種制備方法標(biāo)準(zhǔn)�,有效保證產(chǎn)品制造質(zhì)量?
2.3.4 產(chǎn)品標(biāo)準(zhǔn)體系
產(chǎn)品標(biāo)準(zhǔn)體系細(xì)分為牙科植入物?骨科植入物?心血管植入物和其他植入物��,主要包括應(yīng)用范圍較廣的鈦及鈦合金醫(yī)用植入物產(chǎn)品標(biāo)準(zhǔn)���,其中有三項(xiàng)行業(yè)標(biāo)準(zhǔn):YY/T 0127.4-2023?YY/T 0525-2009?YY/T 0127.8-2001, 在牙科植入物相關(guān)產(chǎn)品標(biāo)準(zhǔn)中共同為牙科植入物和口腔材料的安全性和有效性提供了全面的生物學(xué)評價(jià)體系?骨科植入物標(biāo)準(zhǔn)涵蓋了從骨接合植入物?關(guān)節(jié)置換植入物?脊柱植入物到運(yùn)動醫(yī)學(xué)植入器械等各個(gè)方面的要求�,不僅確保了植入物的性能?安全性和生物相容性�����,還促進(jìn)了技術(shù)的創(chuàng)新與個(gè)性化治療的實(shí)現(xiàn)?
2.3.5 試驗(yàn)方法標(biāo)準(zhǔn)體系
試驗(yàn)方法標(biāo)準(zhǔn)體系細(xì)分為力學(xué)性能?化學(xué)性能?生物安全性��,主要包括醫(yī)用植入物材料性能測試方法標(biāo)準(zhǔn),確保產(chǎn)品的可靠性和安全性?
2.3.6 臨床試驗(yàn)與應(yīng)用標(biāo)準(zhǔn)體系
臨床試驗(yàn)與應(yīng)用標(biāo)準(zhǔn)體系細(xì)分為臨床試驗(yàn)規(guī)范?數(shù)據(jù)分析?跟蹤監(jiān)測,主要包括鈦及鈦合金醫(yī)用植入物在臨床試驗(yàn)和應(yīng)用過程中的規(guī)范和要求?
2.3.7 質(zhì)量管理標(biāo)準(zhǔn)體系
質(zhì)量管理標(biāo)準(zhǔn)體系細(xì)分為環(huán)境管理?安全管理?產(chǎn)品檢驗(yàn)?包裝運(yùn)輸?人員規(guī)范?質(zhì)量控制與檢驗(yàn)是保障醫(yī)用植入物鈦及鈦合金質(zhì)量的關(guān)鍵��,有利于確保產(chǎn)品質(zhì)量符合標(biāo)準(zhǔn)要求��,提高產(chǎn)品質(zhì)量和安全性?對于外科植入物�����,尤其是如全髖關(guān)節(jié)假體這類需要長期與人體接觸的器械,其性能的可靠性和穩(wěn)定性不僅依賴于材料的選擇和設(shè)計(jì),還與試驗(yàn)和儲存環(huán)境的控制密切相關(guān)?產(chǎn)品檢驗(yàn)標(biāo)準(zhǔn)主要用于醫(yī)療器械質(zhì)量體系軟件的確認(rèn)?包裝和運(yùn)輸標(biāo)準(zhǔn)用于確保醫(yī)療器械包裝的無菌安全性?
3、醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系實(shí)施建議
第一,應(yīng)提高標(biāo)準(zhǔn)門檻��,積極與 ISO?ASTM 等國際標(biāo)準(zhǔn)接軌����,確保產(chǎn)品符合全球通用的質(zhì)量要求?第二,應(yīng)完善相關(guān)標(biāo)準(zhǔn),涵蓋原材料?生產(chǎn)工藝和質(zhì)量控制等多個(gè)方面���,尤其要修訂現(xiàn)有標(biāo)準(zhǔn),細(xì)化技術(shù)指標(biāo),確保其適應(yīng)實(shí)際使用需求?標(biāo)準(zhǔn)的制定應(yīng)兼具約束性和開放性����,既要確保產(chǎn)品的安全性���,又要為技術(shù)進(jìn)步預(yù)留空間?第三�����,主管部門應(yīng)加強(qiáng)標(biāo)準(zhǔn)的實(shí)施和監(jiān)督,強(qiáng)化人才隊(duì)伍建設(shè),定期開展標(biāo)準(zhǔn)宣貫和培訓(xùn)工作�����,切實(shí)提高行業(yè)從業(yè)人員對標(biāo)準(zhǔn)的理解和執(zhí)行能力?第四��,標(biāo)準(zhǔn)體系應(yīng)保持動態(tài)優(yōu)化�,根據(jù)技術(shù)進(jìn)步和臨床需求的變化及時(shí)進(jìn)行修訂完善�,確保標(biāo)準(zhǔn)的持續(xù)適用性和先進(jìn)性?
4�����、結(jié)束語
標(biāo)準(zhǔn)化是國家創(chuàng)新發(fā)展的關(guān)鍵����,推動標(biāo)準(zhǔn)體系建設(shè)能提高外科植入產(chǎn)品質(zhì)量���,增強(qiáng)其國際競爭力和市場影響力?因此�����,應(yīng)結(jié)合國內(nèi)產(chǎn)業(yè)水平�,完善相關(guān)標(biāo)準(zhǔn)�,推動新型材料的產(chǎn)業(yè)化和臨床應(yīng)用,促進(jìn)醫(yī)用植入物鈦材產(chǎn)業(yè)的健康發(fā)展?
參考文獻(xiàn)
[1] 譚瑩瑩�����。鈦基植入材料抗氧化功能界面的構(gòu)建及其生物學(xué)評價(jià) [D]. 重慶:重慶大學(xué)�,2022.
[2] 高景恒。關(guān)于醫(yī)用生物材料的安全性評價(jià)與評價(jià)標(biāo)準(zhǔn) [C]// 吉林富華醫(yī)用高分子材料有限公司���,實(shí)用美容整形外科雜志社。首屆國際醫(yī)用聚丙烯酰胺水凝膠:奧美定學(xué)術(shù)研討會論文集��。遼寧省人民醫(yī)院�����,2000:125-135.
作者簡介
張保平��,男,2003 年出生���,標(biāo)準(zhǔn)化工程專業(yè)本科在讀?
通信作者:陶姍���,女�����,1980 年出生���,副教授���,研究方向?yàn)楣I(yè)標(biāo)準(zhǔn)化��,taoshan@cjlu.edu.cn?
(注����,原文標(biāo)題:醫(yī)用植入物鈦及鈦合金標(biāo)準(zhǔn)體系構(gòu)建研究)
相關(guān)鏈接